
锰基普鲁士蓝/GO复合材料制备及储钠性能研究
据能源圈了解到,
摘要:采用简易溶液共沉淀法制备了Na2MnFe(CN)6/氧化石墨烯(graphene oxide, GO)复合材料[Na2MnFe(CN)6/GO]。GO的加入有利于提高材料的离子传导和结构稳定,进而提升材料的倍率性能和循环稳定性。结果表明:在0.2 C (1 C=170 mAh/g)下,Na2MnFe(CN)6和Na2MnFe(CN)6/GO初始放电比容量分别为108.74和119.83 mAh/g;经过50次循环后,Na2MnFe(CN)6的容量保持率为62.0%,Na2MnFe(CN)6/GO的容量保持率为79.5%。Na2MnFe(CN)6/GO具有较大的扩散系数,有利于离子的扩散。表明GO的加入,能有效提升材料的倍率性能和循环稳定性。
关键词:氧化石墨烯;普鲁士蓝类似物;正极材料;钠离子电池
在众多电化学储能器件中,由于钠离子电池与锂离子电池具有相似的工作原理,且资源丰富,开发成本低,近年来受到科研人员的广泛关注。钠离子电池正极材料主要分为三类:过渡金属层状氧化物[1]、聚阴离子型化合物[2]、普鲁士蓝类似物(PBAs)[3]。普鲁士蓝类似物通式为NaxM[Fe(CN)6]y·1-y·nH2O[其中M为过渡金属, 为空位缺陷,0x2, y= (x+ 2)/4],具有优异的氧化还原活性、开放的三维离子迁移通道、充放电过程中高度可逆的相变、可调的电压平台、易于合成和低成本等优点,因此被认为是一种有前途的钠离子电池正极材料[4]。
但是Na2MnFe(CN)6存在循环稳定性差的问题[5]:(1)结晶水占据了晶体中的储钠位点及钠离子脱嵌通道,减少了Na+的活性位点,影响了Na+扩散速率,同时配位水扭曲晶格结构,与电解液容易发生副反应,催化电解液分解,降低库仑效率和结构稳定性;(2)缺陷的存在(主要是空位)一方面直接减少了活性位点,降低了容量,另一方面空位切断了离子连续传输的通道,引起晶格扭曲,加剧晶格形变甚至导致结构倒塌;(3)锰的歧化反应,导致部分锰以Mn2+溶解于电解液,引起Na2MnFe(CN)6的结构变化。
为了提升锰基普鲁士蓝材料的倍率性能和循环稳定性,科研人员已经从锰基普鲁士蓝与碳材料复合的角度做了大量的工作。Wang等[6]通过简易共沉淀方法成功制备了Na2MnFe(CN)6/还原氧化石墨烯复合材料(NMHCF/RGO)。RGO(reduced graphene oxide)的存在不仅提高了电子电导率和离子电导率,而且有助于消除间隙水。作为阴极,NMHCF/RGO在电流密度为20 mA/g的情况下,提供了161 mAh/g的较高初始比容量;在1 000 mA/g下,电池仍能提供83 mAh/g的稳定放电比容量。此外,所组装的NMHCF/RGO//硬碳全电池,在经过50次循环后,具有84 mAh/g的高度可逆放电比容量。Lee等[7]通过简单的共沉淀方法引入碳纳米管(CNT)成功制备了一种普鲁士白/CNT复合阴极材料(PW-CNT)。在0.1 C下,PW-CNT复合材料的初始放电比容量为141 mAh/g,高于普鲁士白(Prussian white, PW)的初始放电比容量139 mAh/g,且经过100次充放电循环后,PW-CNT复合材料的容量保持率为74%,远高于PW的容量保持率(60%);与PW阴极相比,PW-CNT复合阴极具有更大的钠存储容量和优越的循环稳定性。通过整理前人的研究成果发现,引入合适的碳材料可以有效提升材料的倍率性能和循环稳定性。
本文采用简易溶液共沉淀法制备了Na2MnFe(CN)6/GO。通过表征和电化学测试,证明了GO的加入能有效提升材料的倍率性能和循环稳定性。
1 实验
1.1 实验原料
单层GO分散液,2 mg/mL,上海迈瑞尔生化科技有限公司;一合水硫酸锰(MnSO4·H2O),国药集团;氯化钠(NaCl),导电炭黑,麦克林生化科技有限公司;柠檬酸钠(C6H5O7Na3),十水合亚铁氰化钠[Na4Fe(CN)6·10 H2O],金属钠块,阿拉丁化学试剂有限公司;聚偏氟乙烯(PVDF),河南阿尔法化工有限公司;铝箔,20 m,郑州景弘新能源科技有限公司;玻璃纤维隔膜,GF/D,Whatman;电解液:NaClO4 (1 mol/L 碳酸丙烯酯+5%氟代碳酸乙烯酯),多多化学试剂有限公司;电池壳,CR2032,深圳市科晶智达科技有限公司。
1.2 实验仪器
场发射扫描电子显微镜(SEM,S-4800,日本Hitachi公司)、X射线粉末衍射仪(XRD,D8 Advance,德国Carl Zeiss公司)、透射电子显微镜(TEM,Tecnai F20,美国FEI公司)、共聚焦显微拉曼光谱仪(Raman,InVia Refiex,英国Renishaw公司)、X射线光电子能谱仪(XPS,Axis Utltradld,日本岛津公司)、热重分析仪(TG,TG 209F3,德国耐驰公司)、LAND电池测试系统(CT3002A,武汉蓝电电子股份有限公司)、电化学工作站(1407E,英国输力强精密测量有限公司)。
1.3 样品的制备
1.3.1 Na2MnFe(CN)6材料的制备
称取2.5 mmol的MnSO4·H2O和3 mmol的C6H5O7Na3溶于50 mL去离子水中并搅拌均匀形成溶液,标记为A。将2.5 mmol Na4Fe(CN)6·10 H2O溶于50 mL去离子水中,搅拌均匀形成溶液,标记为B。将14 g NaCl溶于50 mL去离子水中,搅拌均匀形成溶液,标记为C。随后将A和B溶液通过蠕动泵以10 mL/min的速度同时加入到C溶液中,待溶液滴加完毕后,继续搅拌2 h,随后将混合后的溶液静置12 h,用去离子水和乙醇反复抽滤洗涤,最后将制备出的样品放入120 ℃真空干燥箱中干燥12 h,得到产物Na2MnFe(CN)6(标记为MnHCF)。
1.3.2 Na2MnFe(CN)6/GO复合材料的制备
称取2.5 mmol的MnSO4·H2O和3 mmol的C6H5O7Na3溶于50 mL去离子水中并搅拌均匀形成溶液,标记为A。将2.5 mmol Na4Fe(CN)6·10 H2O溶于50 mL去离子水中,搅拌均匀形成均一溶液,标记为B。将25 mLGO水溶液和25 mL去离子水加入到烧杯中并超声形成均一溶液,随后将14 g NaCl溶于上述溶液中,搅拌均匀形成溶液,标记为C。随后将A和B溶液通过蠕动泵以10 mL/min的速度同时加入到C溶液中,待溶液滴加完毕后,继续搅拌2 h,随后将混合后的溶液静置12 h,用去离子水和乙醇反复抽滤洗涤,最后将制备出的样品放入120 ℃真空干燥箱中干燥12 h,得到产物Na2MnFe(CN)6/GO(标记为MnHCF/GO)。
1.4 电极制备及电化学性能测试
电极的制备:活性物质、导电碳(Super P)、PVDF按照质量比7∶2∶1置于研钵中,研磨20 min,随后加入适量的N-甲基吡咯烷酮(NMP),搅拌5 h,形成浆料。将浆料通过涂布机均匀涂布于铝箔上,转移至120 ℃的真空烘箱中干燥12 h,获得正极片。以NaClO4 (1 mol/L 碳酸丙烯酯+5%氟代碳酸乙烯酯)为电解液,金属钠片为负极,隔膜为Whatman GF/D,在充满氩气的手套箱中(氧、水含量均小于0.110-6)组装成半电池,利用蓝电电池测试系统进行电化学测试,充放电测试电压为2.0~4.0 V (vs. Na/Na+)。交流阻抗测试(EIS)电位振幅为5 mV,测试频率范围为0.01 Hz~100 kHz。
2 结果与讨论
2.1 样品SEM和TEM分析
图1为MnHCF、MnHCF/GO和GO不同放大倍数的SEM图。从图1 (a)和图1 (d)可以看出,MnHCF材料呈现大小不均匀的颗粒状,直径在200 ~600 nm之间。图1 (b)和 (e)为制备的MnHCF/GO复合材料,加入GO后,与MnHCF相比,MnHCF/GO具有规则的立方形貌,有利于提高材料的电化学性能;MnHCF锚定在GO表面,有助于MnHCF在充放电过程中的稳定性;MnHCF在GO表面生长,阻止了MnHCF材料的团聚,有助于离子的快速传输,从而提高活性材料的离子电导率。图1 (c)和(f)可以看出,GO为单层薄片且具有较大的面积。

图1 (a, d) MnHCF; (b, e) MnHCF/GO; (c, f) GO三种材料SEM图
图2为MnHCF/GO的TEM和能量色散X射线谱(EDS)。从图2 (a)可以清晰地看出,GO是单层薄片状,其中,MnHCF锚定在GO表面,并且MnHCF材料无明显团聚现象。图2 (b)~(g)为各元素映射(EDS)图证明Na、Mn、Fe、C、N和O元素在材料中是均匀分布的。

图2 MnHCF/GO的(a) TEM; (b) ~ (g)各元素映射(EDS)图
2.2 样品XRD分析
图3为MnHCF与MnHCF/GO的XRD图谱,MnHCF和MnHCF/GO均表现出明显的菱面体相衍射峰(空间群R3m,a = b =1.502 nm,c =1.708 nm)[8],与普鲁士蓝Fe4[Fe(CN)6]3的标准卡片JCPDS NO.73-0687相比,两种样品有(200)、(220)、(400)、(420)等主要晶面衍射峰,这表明样品具有普鲁士蓝化合物晶体结构[9]。MnHCF和MnHCF/GO具有相同的峰位置,表明MnHCF和MnHCF/GO具有相似的晶格结构。因此,GO的加入并没有改变MnHCF的晶体结构。
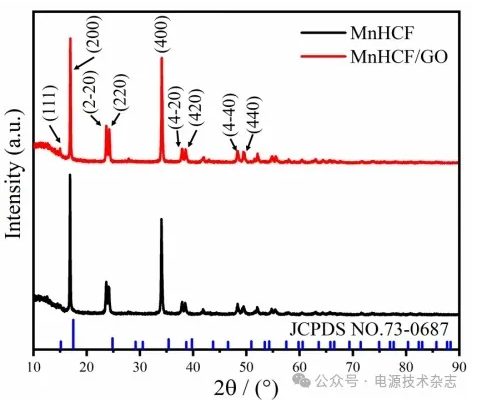
图3 两种材料的XRD图谱
2.3 红外光谱(FT-IR)和拉曼光谱(Raman)分析
图4(a)和(b)为MnHCF与MnHCF/GO两种材料的红外光谱和拉曼光谱图。两种样品的红外光谱非常相似,1 618和3 453 cm−1处吸收峰分别对应于配位水和吸附水产生的O-H键的伸缩振动,说明两种样品中都存在少量的结晶水;2 067和595 cm−1处吸收峰归因于-CN和Fe-CN键的伸缩振动。通常碳材料在拉曼光谱中表现出两个带宽,被称为D带和G带,其中,G带是指在800~2 250 cm−1之间的波长。图4(b)中1 347和1 600 cm−1处的峰分别对应于GO的D峰和G峰[10]。G带表示平面内碳与sp2杂化碳在完整的蜂窝单元中的拉伸运动,D带与石墨烯缺陷含量有关。MnHCF/GO拉曼光谱图中出现了明显的D峰和G峰,证明了GO在MnHCF/GO中的存在。MnHCF与MnHCF/GO均在2 086 cm−1处和2 127 cm−1处具有明显的特征峰,其中2 086 cm−1处的峰为CN基团,2 127 cm−1处的峰则属于Fe-CN-Mn键,表明GO的加入未改变MnHCF的晶体结构,与XRD表征结果一致。

(a)红外光谱;(b)拉曼光谱
图4 两种材料的红外光谱和拉曼光谱
2.4 样品X射线光电子能谱(XPS)分析
为了进一步证明材料中Fe、Mn和C的价态,对MnHCF/GO进行X射线光电子能谱测试。MnHCF/GO在结合能为708.6和721.4 eV处分别对应于FeⅡ2p3/2和FeⅡ2p1/2,结合能为723.7 eV对应于FeⅢ2p1/2,说明MnHCF/GO中 Fe2+是Fe元素存在的主要价态,只有少量的Fe2+被氧化成Fe3+[图5(a)所示]。MnHCF/GO在结合能为641.4和653.3 eV处,分别对应于MnⅡ2p3/2和MnⅡ2p1/2;在结合能为643和654.5 eV 处,分别对应于MnⅢ2p3/2和MnⅢ2p1/2,说明MnHCF/GO中Mn2+价态是Mn的主要存在形式,同时也说明材料中含有少量的Mn3+[11][图5(b)所示]。MnHCF/GO在结合能为288.40、286.76和284.80 eV处分别对应O-C=O、C-N/CN和C-C[12][图5(c)所示]。

(a) Fe 2p; (b) Mn 2p; (c) C 1s
图5 MnHCF/GO的XPS拟合图
2.5 样品热重(TG)测试分析
在25~800 ℃氮气氛围中对MnHCF和MnHCF/GO两种材料进行热重测试,结果如图6所示。在240 ℃附近之前的质量减少归因于材料中水的消耗,MnHCF/GO材料的间隙水含量从15.73%下降到15.27%,说明MnHCF/GO比MnHCF含有更低的间隙水,而MnHCF中较高含量的间隙水可能会导致Na+可用的位置减少和可用嵌入容量的损失[13]。
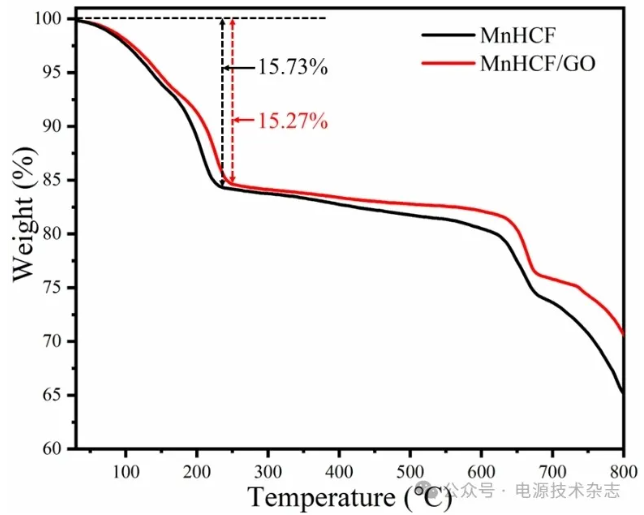
图6 两种材料的热重曲线
2.6 电池的电化学性能分析
图7(a)和(b)为MnHCF和MnHCF/GO在0.1 C下前三次的容量电压曲线。从图中可以看出,在相同倍率下,MnHCF/GO材料的初始放电比容量均为121.38 mAh/g,而MnHCF的初始放电比容量为113.81 mAh/g,低于MnHCF/GO。从前三次循环可以看出,MnHCF/GO的放电比容量几乎没有衰减,而MnHCF的放电比容量出现较为明显的衰减。MnHCF/GO材料表现较高的初始比容量和优异的循环稳定性的原因可能是其晶格中相对较少的间隙水含量、减少MnHCF材料团聚以及GO的复合作用。GO的加入,有效降低了结构中间隙水的含量,更少的间隙水含量意味着有更多的Na+储存位点,同时有利于材料的均匀分散,阻止了MnHCF材料团聚,加快了离子快速迁移和活性材料的利用。因此,MnHCF/GO具有较高的初始比容量。GO在MnHCF材料表面形成保护层能有效缓解材料所受应力,减少结构塌陷以及副反应的发生。因此,MnHCF/GO表现出优于MnHCF的循环稳定性。
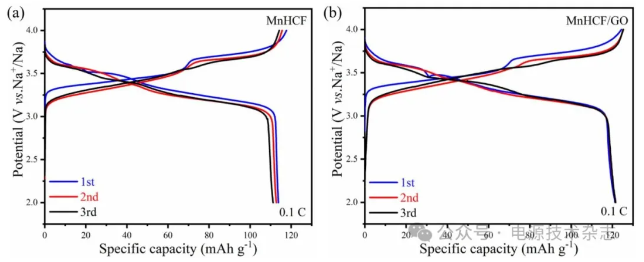
图7 MnHCF和MnHCF/GO两种材料前三次的容量电压曲线
图8(a)和(b)为MnHCF和MnHCF/GO两种材料在0.2 C下不同次数的容量电压曲线。从图中可以看出,随着循环次数的增加,两种材料呈现出不同程度的衰减。其中,MnHCF在前20次的衰减明显快于MnHCF/GO,归因于MnHCF材料在前20次内发生了副反应,而MnHCF/GO表现出稳定的循环性能得益于GO的复合作用。
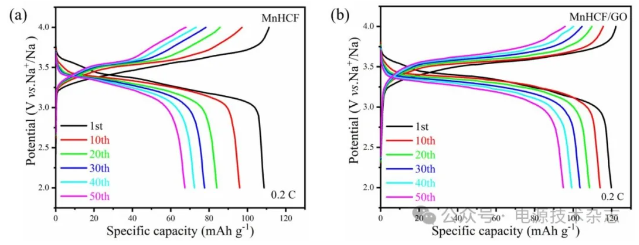
图8 MnHCF和MnHCF/GO两种材料不同次数的容量电压曲线
图9(a)为 MnHCF和MnHCF/GO在0.2 C下循环50次的循环曲线。从图中可以看出,MnHCF和MnHCF/GO的初始比容量分别为108.74和119.83 mAh/g,经过50次循环后,MnHCF/GO的放电比容量为95.33 mAh/g,容量保持率为79.5%,明显高于MnHCF的67.40 mAh/g的放电比容量和62.0%的容量保持率。MnHCF晶体结构的不稳定性是其循环性能较差的主要原因,在其框架中经常出现间隙水,扭曲晶格结构,严重影响结构的稳定性;在Na+嵌入/脱出的过程中,材料会发生形变,导致结构扭曲和坍塌,严重影响结构的稳定性。GO的加入能有效降低结构中间隙水的含量,减少晶格扭曲;同时在MnHCF材料表面形成保护层能有效缓解材料所受应力,减少结构塌陷以及副反应的发生。因此,MnHCF/GO表现出优于MnHCF的循环稳定性。
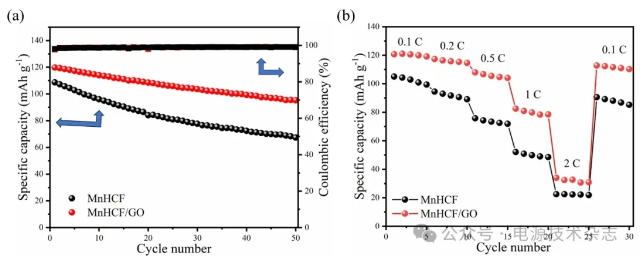
(a) 0.2 C长循环测试;(b)倍率性能测试
图9 两种样品性能曲线
图9(b)为两种材料的倍率性能对比图。从图中可以看出随着倍率的逐渐增大,两种材料之间的可逆比容量差异变得更加明显。在0.1 C、0.2 C、0.5 C、1 C和2 C下各循环5次,最后再回到0.1 C,MnHCF/GO的放电比容量均大于MnHCF,这是因为GO的加入促进了材料的均匀分散,阻止了MnHCF材料团聚,有利于钠离子在充放电过程中的快速嵌入和脱出,加快离子快速迁移,从而提高材料的离子电导率。因此,MnHCF/GO表现出优于MnHCF的倍率性能。
2.7 交流阻抗(EIS)分析
图10为MnHCF和MnHCF/GO的拟合交流阻抗图。半圆直径表示电荷转移电阻(Rct),其中MnHCF和MnHCF/GO的拟合电阻分别为743.7和533.8 Ω,与MnHCF相比,MnHCF/GO的电极内阻明显降低。原因可能是MnHCF/GO中GO的存在可以加速电解质表面与电极之间的电子转移速率。MnHCF/GO在低频区域的拟合线斜率比MnHCF大,表明MnHCF/GO具有较大的扩散系数,有利于离子的扩散,这与高频区的分析结果一致,进一步证明MnHCF/GO复合材料具有优异的电化学性能[12]。
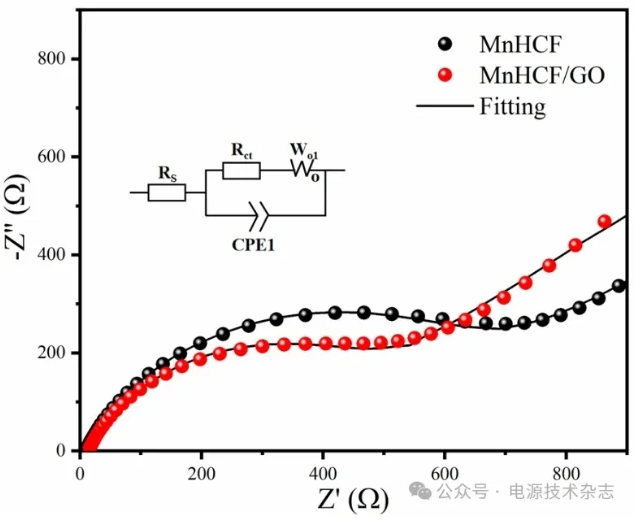
图10 两种材料的交流阻抗(EIS)分析
3 结论
本研究通过简单共沉淀方法成功合成了一种MnHCF/GO复合材料,并对其物理性能和电化学性能进行了表征。结果表明,GO的加入使得MnHCF/GO具有较低的间隙水含量,MnHCF/GO具有较大的扩散系数,有利于离子的扩散,提高了材料的离子电导率。MnHCF/GO所组装的电池也表现出比MnHCF更好的倍率性能和循环稳定性,在0.2 C下循环50次后的放电比容量为99.2 mAh/g,容量保持率为79.5%,高于MnHCF 67.4 mAh/g的放电比容量和62%的容量保持率。
资讯来源:电源技术杂志
免责声明: 本站内容转载自合作媒体、机构或其他网站的信息,转载此文仅出于传递更多信息的目的,但这并不意味着赞同其观点或证实其内容的真实性。本站所有信息仅供参考,不做交易和服务的根据。本站内容如有侵权或其它问题请及时告之,本网将及时修改或删除。凡以任何方式登录本网站或直接、间接使用本网站资料者,视为自愿接受本网站声明的约束。