
废旧磷酸铁锂电池回收工艺研究
据能源圈了解到,
摘要:以废旧磷酸铁锂正极材料中磷酸锂的回收为目标,设计单因素实验,采用磷酸对废旧磷酸铁锂电池粉末中的锂进行选择性浸出,得出锂元素浸出最佳工艺条件。磷酸浓度为3.41 mol/L,固液比为1∶5,在搅拌速度为500 r/min下,水浴温度70 ℃浸出3 h,锂元素的浸出率达到94.16%。随后通过氨水调节pH,得出锂元素沉淀最佳工艺条件:pH值为8的浸出液在60 ℃的水浴温度下反应2 h,沉淀率达到了96.78%。通过单因素实验,降低了实验成本,所设计的回收方案可在一定程度上缩短工艺流程,减少设备投入。
关键词:废旧磷酸铁锂;选择性浸出;回收;磷酸锂;锂离子电池
以锂离子电池为支撑的新能源汽车产业在过去十年中取得了快速增长和巨大的商业成功。橄榄石型磷酸铁锂(LiFePO4)由于其具有化学稳定性和热稳定性,无毒,经济且易获得,在电动汽车和储能设施中得到大规模的利用。但因其作为动力电池使用寿命为8~10年,到目前为止产生了大量的废弃磷酸铁锂电池[1]。与自然界中的锂元素相比,废电池中的锂含量相对丰富[2-5]。而我国锂资源缺乏,为贫锂国家,十分依赖进口[1]。因此,对废弃磷酸铁锂电池的后续处理具有重要的经济价值和环保意义[6]。
目前电池的回收方法可分为:干法回收、湿法回收、生物回收和其它/综合回收法。整个再生利用过程基本上是由预处理、分离处理、回收处理、除杂和再利用过程组成。预处理方法主要分为热处理、物理分选、机械处理(拆解、粉碎等)及电化学处理等。干法回收是指不借助液态媒介而实现有价金属和材料的直接回收,涉及的方法有高温热解法和物理分选法。湿法回收是对废旧电池先进行破碎分选,再进行溶解浸出,最后进行分离回收的处理过程,湿法回收包括湿法冶金、化学萃取及离子交换等。
按照技术原理的不同,处理废旧磷酸铁锂正极粉末的工艺主要可分为两类,即再生修复法和湿法浸出提取法[7]等。其中,再生修复法主要是通过补锂等方式恢复失效的磷酸铁锂正极材料的电化学性能,此方法工艺简单,但也存在一些缺陷。首先,经过数千次充放电过程,使用过的磷酸铁锂正极中锂、铁、磷元素的比例难以保持稳定。其次,许多杂质也会被引入回收的正极中。因此与原始磷酸铁锂正极材料相比,修复后的磷酸铁锂正极材料往往表现出较差的电化学性能[8-14]。而湿法浸出提取法主要是通过浸出过程使废旧磷酸铁锂正极粉末中的有价金属锂铁进入溶液,再进行除杂富集,回收有价元素Li。湿法浸出提取法具有金属回收率高、除杂效率高、技术适应性强的优点,是目前主流的处理技术[15]。
针对上述问题,迫切需要一种高效、经济、环保的方法来回收废旧的LiFePO4正极材料,既可以解决LFP报废造成的环境问题,也可以缓解含锂资源枯竭的问题[3,8,16-18]。本文使用磷酸选择性地从废旧磷酸铁锂电池正极材料中浸出Li,同时,Fe以磷酸铁残渣的形式保留。此工艺以磷酸为浸出酸不会引入外来元素[19],这对经济和环境都有明显的效益。
1 实验
1.1 材料和试剂
实验过程中所使用的化学试剂均为分析纯,溶液均采用去离子水配制而成,实验过程中的废旧磷酸铁锂电池来自国内某公司。H3PO4溶液和氨水为试剂级,分离废旧正极集流体后获得正极材料,随后采用电感耦合等离子体光谱仪(ICP)测定废旧磷酸铁锂正极粉末中各元素含量(质量分数),结果如表1所示。另将正极材料在马弗炉600 ℃下高温处理6 h得到铁锂粉。
表1 废旧磷酸铁锂正极材料的ICP分析结果 %

1.2 设备与仪器
设备与仪器:DF-101S集热式恒温加热磁力搅拌器,SHZ-D(Ⅲ)循环水式真空泵,BS 124 S电子天平,PHSJ-4A实验室pH计,101-2电热鼓风干燥箱,SX2-5-12A箱式电阻炉,ICAP 7400 ICP电感耦合等离子体光谱仪。
1.3 浸出实验
浸出实验在三颈烧瓶(250 mL)中进行,采用磷酸作为浸出剂,使用集热式恒温加热磁力搅拌器来控制温度。通过控制磷酸浓度、浸出温度、浸出时间和固液比来提高有价金属锂的浸出率。浸出后采用循环水式真空泵进行抽滤处理得到浸出液,并用式(1)计算元素浸出率:

式中:为浸出率;c为目标元素在浸出液中的浓度,mg/L;V为浸出液的体积,L;w为相应元素在电极中的质量分数;m为实验所用磷酸铁锂质量,g。
1.4 沉淀实验
确定最佳浸出条件后,在最佳浸出条件下进行实验以收集浸出溶液,随后取50 mL体积的浸出液,采用氨水调节浸出液的pH值,使用集热式恒温加热磁力搅拌器控制温度,使Fe和Li分步沉淀。通过控制实验pH值、沉淀温度和沉淀时间来提高锂的沉淀率。沉淀后立即将其取出在循环水式真空泵进行抽滤,抽滤后进行烘干处理。对滤液中Li含量进行检测,并用公式计算元素沉淀率。图1为实验流程图。
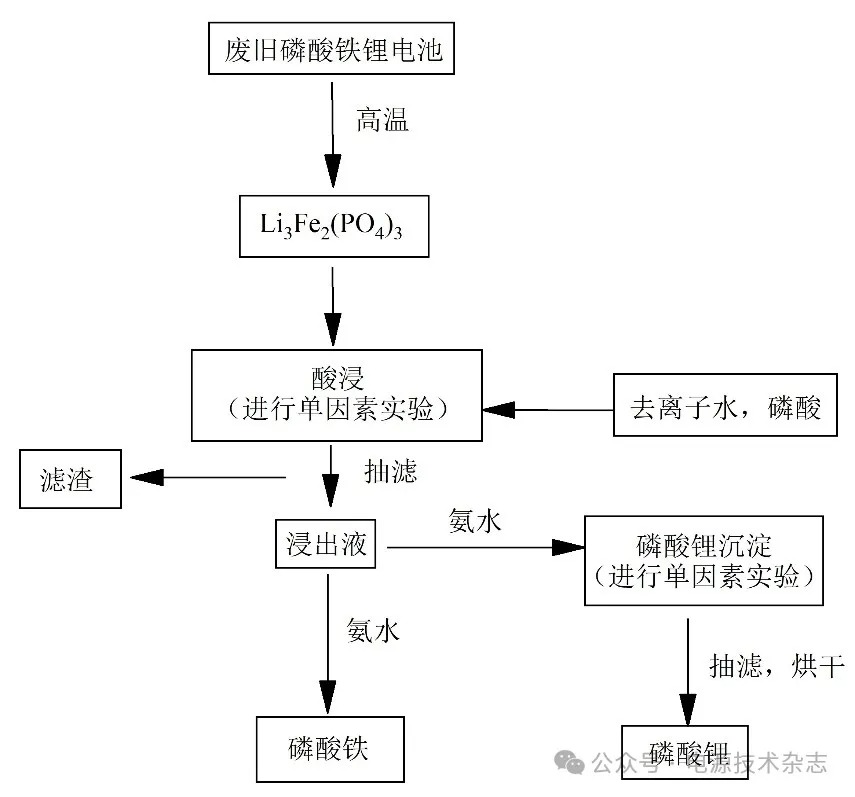
图1 实验流程图
2 结果与讨论
2.1 酸浸法浸出LiFePO4正极材料分析
还原酸浸法浸出金属离子的原理是利用酸使活性物质元素(铁、磷、锂等)还原、分解并进入溶液中,从而实现与导电剂和粘结剂的分离。在未经高温处理和加入酸时,正极活性物质LiFePO4仅能靠自身发生氧化还原反应,从而导致部分损失锂后的FePO4难以被还原成Fe2+溶出,所以此时正极材料的溶解率较低。而本实验在酸浸前就将正极材料全部经高温处理得到Li3Fe2(PO4)3,且加入酸后,还原性环境有利于FePO4还原成Fe2+溶出,从而提高浸出率,同时酸性环境有利于抑制Fe2+的氧化。在酸浸过程中,磷酸与铁离子可以形成一种络合物,即磷酸络合铁。这种络合物是通过配体的配位作用实现的。具体来说,磷酸作为一种强配体能够与金属离子形成稳定的络合物,其中包括与铁离子形成的络合物。在络合反应中,磷酸中的氧原子通常是配体与铁离子形成配位键的主要位点。这些氧原子与铁离子中的可供配位的电子对形成化学键,通常是通过共价键或配位键的形式。这种配位键的形成使得配体能够与铁离子紧密结合,并形成稳定的络合物。有机酸提供还原性环境的同时,有机酸和铁离子的络合作用使铁的浸出率增加。实验发生的化学反应如下:
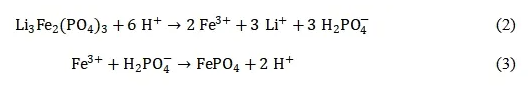
2.2 浸出条件优化
通过改变温度、反应时间、磷酸浓度、固液比和转速等条件来探究最佳浸出条件,对浸出实验进行优化。
2.2.1 固液比对锂浸出率的影响
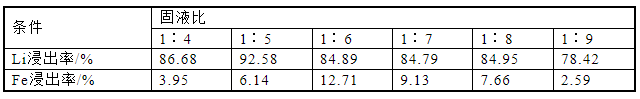
为了研究不同固液比对锂浸出速率的影响,探究了固液比对锂和铁浸出率的影响。按照不同固液比配成20、25、30、35、40和45 mL的混合溶液,在80 ℃下反应,搅拌速度为500 r/min,反应时间2 h,分别计算元素浸出率。实验结果如图2和表2所示,随着废阴极材料与去离子水的比例增加,Li的浸出率总体呈降低趋势,在1∶5的固液比下,浸出率达到最高,为92.58%。Fe浸出率在固液比1∶4~1∶6下升高,在固液比1∶6下达到最高,为12.71%,随后逐渐减低。废阴极粉固液比低,与磷酸溶液充分接触,有利于Li、Fe浸出。因此,Li、Fe的浸出率在一定的固液比范围内变化不大。然而,进一步增加的固液比趋向于废阴极粉末和磷酸溶液之间的固液接触,Li、Fe的浸出率受到抑制。根据实验结果和分析,选择固液比为1∶5继续进行研究。
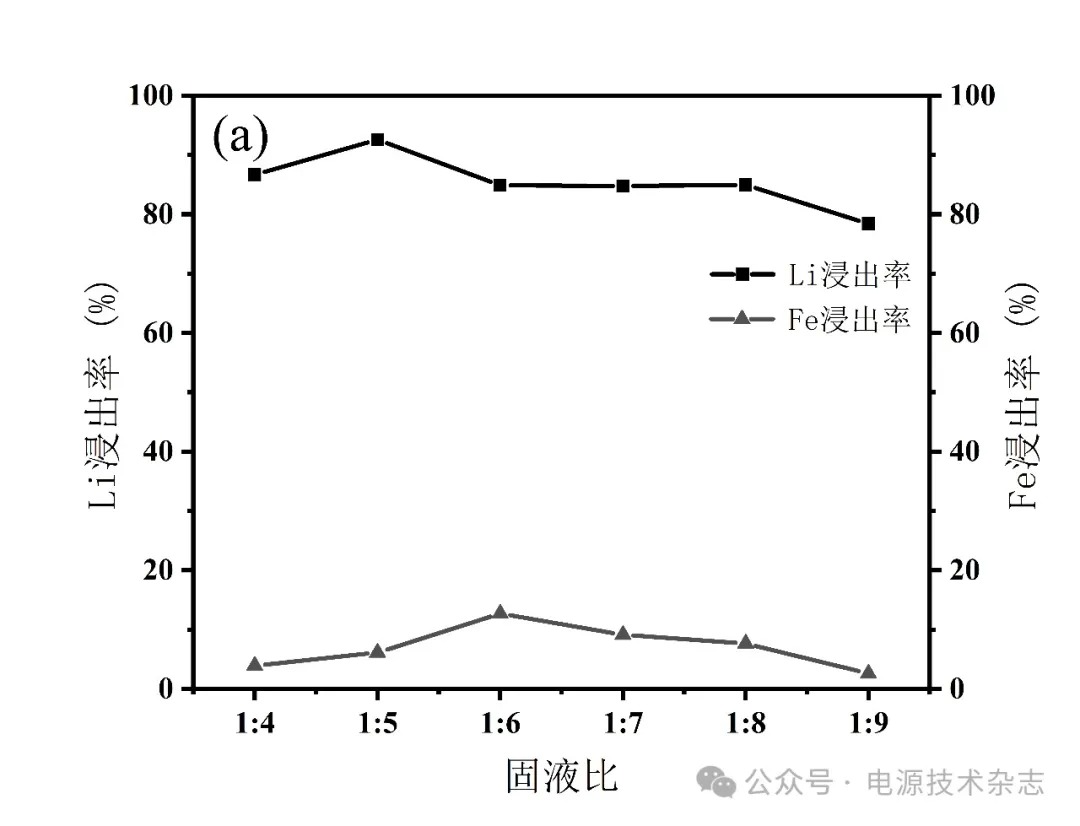
图2 固液比对锂铁浸出率的影响
表2 固液比对锂铁浸出率的影响
2.2.2 磷酸浓度对锂浸出率的影响
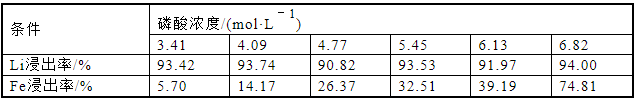
为研究不同磷酸浓度对Li浸出率的影响,按照固液比1∶5分别配成25 mL不同磷酸浓度(3.41、4.09、4.77、5.45、6.13、6.82 mol/L)的混合溶液,由于更低浓度磷酸进行实验无法得到浸出液,得到的是白色固状废料,因此采用3.41 mol/L的磷酸进行实验。在80 ℃下,搅拌速度为500 r/min,反应时间2 h,分别计算元素浸出率,实验结果如图3和表3所示。从图3和表3可以看出,当磷酸浓度从3.41 mol/L增加至6.82 mol/L时,Li的浸出率基本维持在93.00%,无明显的变化,可以认为作为反应物的磷酸,其浓度在3.41~6.82 mol/L的区间内始终可以使得Li几乎完全浸出。而Fe的浸出率在磷酸浓度增加的过程中逐步增加,在磷酸浓度为3.41 mol/L时,铁的浸出率仅为5.70%,而在磷酸浓度为6.82 mol/L时,铁的浸出率达到了74.81%,这是因为在增加反应物磷酸浓度的过程中[20],促进了浸出反应正向进行。考虑到Li的浸出效果和实验成本,以及后续除铁流程,选择磷酸浓度为3.41 mol/L进行后续研究。
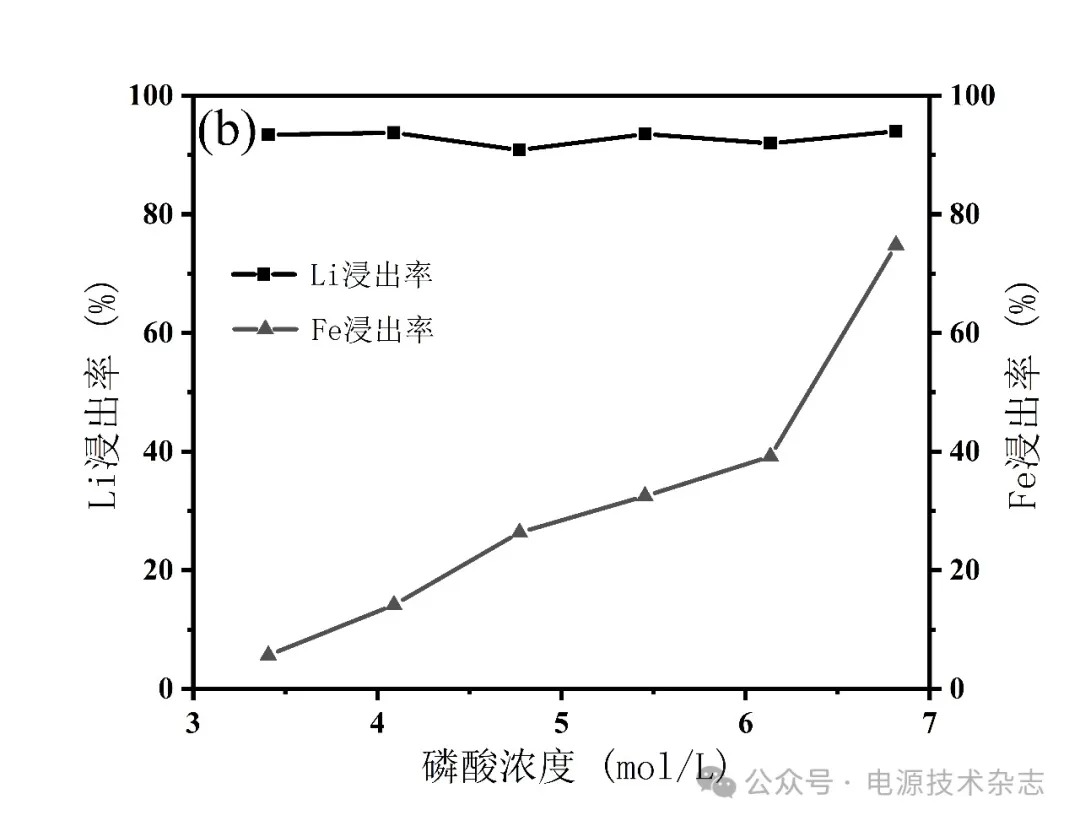
图3 磷酸浓度对锂铁浸出率的影响
表3 磷酸浓度对锂铁浸出率的影响
2.2.3 水浴温度对锂浸出率的影响
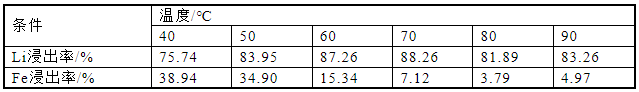
为了研究不同水浴温度对Li浸出率的影响,将温度范围控制在40~90 ℃,按照固液比1∶5配成25 mL磷酸浓度为3.41 mol/L的混合溶液,反应时间2 h,搅拌速度500 r/min,分别计算元素浸出率,实验结果如图4和表4所示。图4和表4显示,在40 ℃下反应2 h后,Li浸出率为75.74%,随着温度的升高,浸出率增加,在70 ℃时达到最高,为88.26%,随后,Li浸出率略微下降,稳定在82%。Fe的浸出率在整个过程中随温度升高而下降,从38.94%下降到4.97%。这种情况可以解释为反应温度的升高促进了化学反应的平衡。温度的升高加快了化学反应的速度,促进了锂离子的溶解,且由于Fe和Li的竞争浸出,Fe的浸出率降低。然而,反应完成后,锂的浸出率不会改变,因此锂的浸出率不会随着温度的进一步升高而显著变化。因此,考虑到温度升高引起的能耗增加,反应温度应控制在70 ℃。
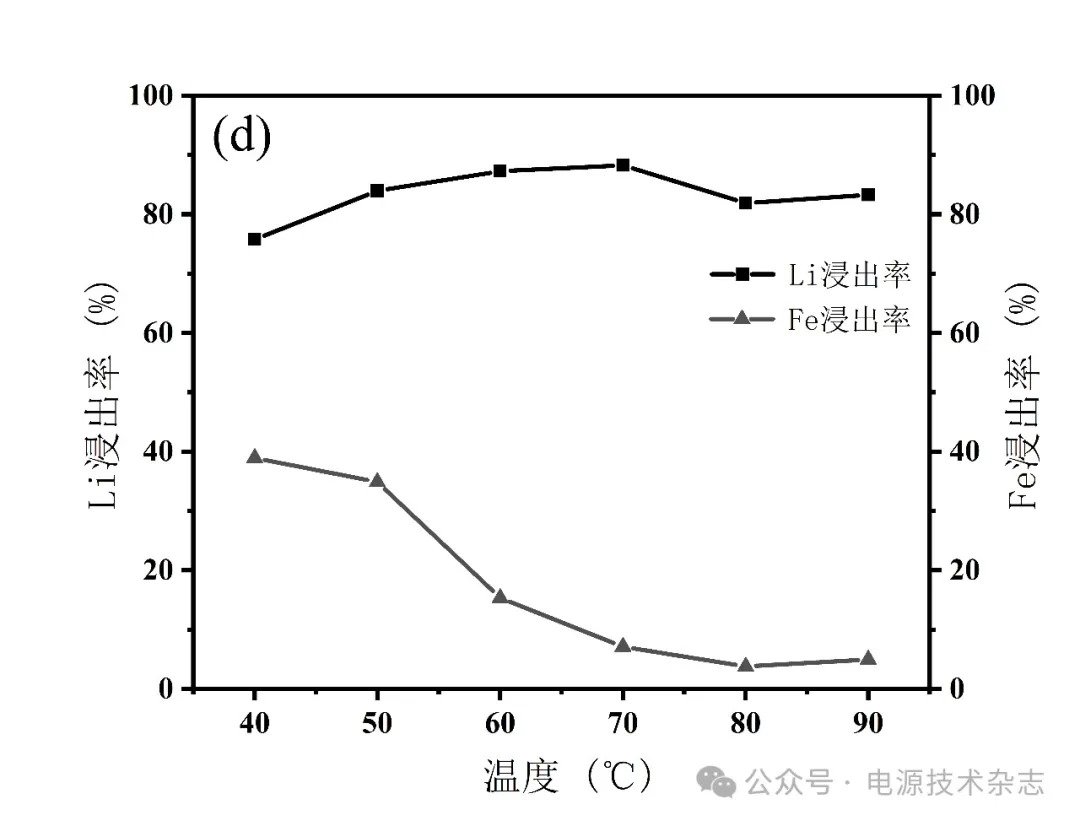
图4 水浴温度对锂铁浸出率的影响
表4 水浴温度对锂铁浸出率的影响
2.2.4 转速对锂浸出率的影响
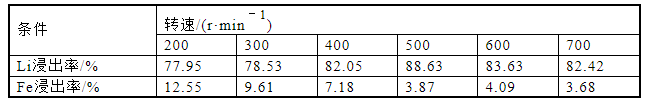
为研究不同转速对Li浸出率的影响,转速控制在200~700 r/min,按照固液比1∶5配成25 mL的磷酸浓度为3.41 mol/L的混合溶液,水浴温度70 ℃,反应时间2 h,分别计算元素浸出率,实验结果如图5和表5所示。浸出率没有随转速变化发生显著变化,其中Li离子浸出率最高为88.63%,反应时间为2 h。在转速为200~500 r/min时,Li浸出率随转速增加而增大,在500 r/min时达到最高,随后略微降低至82.42%。Fe的浸出率在整个过程中随转速的增加而降低,从12.55%降至3.68%。从结果可知,转速对浸出率无显著影响,因为不同的转速下浸出率都相当高。浸出率在增大转速内的波动归因于反应不充分。因此,转速控制在500 r/min以内,可以降低设备成本,同时保持良好的浸出率。考虑到Li元素完全浸出的因素和设备成本,转速设定为500 r/min。
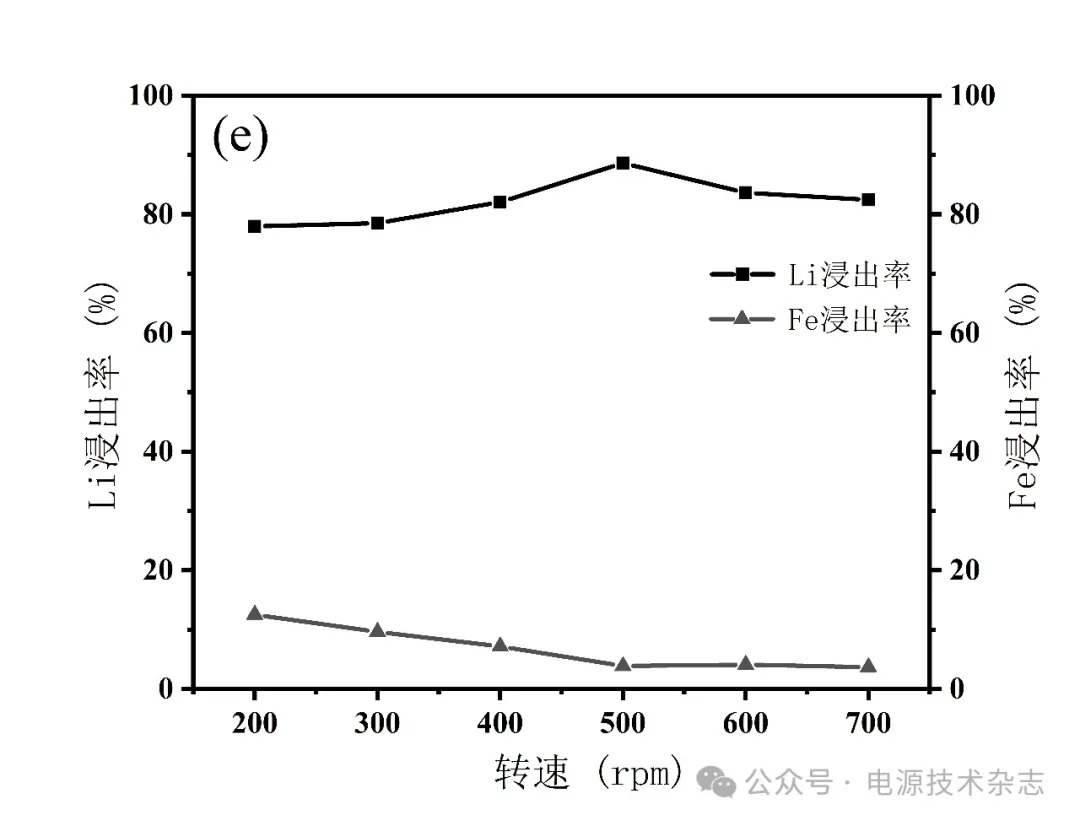
图5 转速对锂铁浸出率的影响
表5 转速对锂铁浸出率的影响
2.2.5 反应时间对锂浸出率的影响
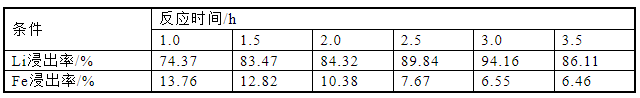
为研究不同反应时间对Li浸出率的影响,反应时间控制在1~3.5 h,按照固液比1∶5配成25 mL磷酸浓度为3.41 mol/L的混合溶液,在70 ℃下反应,搅拌速度为500 r/min,分别计算元素浸出率,实验结果如图6和表6所示。浸出率随反应时间从1 h延长至3.5 h而发生显著变化,其中Li离子浸出率在反应时间为3 h时最高,为94.16%。在1~3 h中,Li浸出率随时间增加而升高,在3 h达到最高,随后略微降低至86.11%。Fe的浸出率在整个过程中随反应时间增加而降低,从13.76%降至6.46%。从结果可知,反应时间对浸出率有显著影响。浸出率在延长反应时间内的波动归因于短时间内未充分反应。根据实验结果,可以得出一个总体结论,即不需要很长的反应时间来确保高浸出率。因此,反应时间控制在3 h以内,可以降低时间成本,同时保持良好的浸出率。考虑到锂元素完全浸出的因素和时间成本,反应时间设定为3 h。
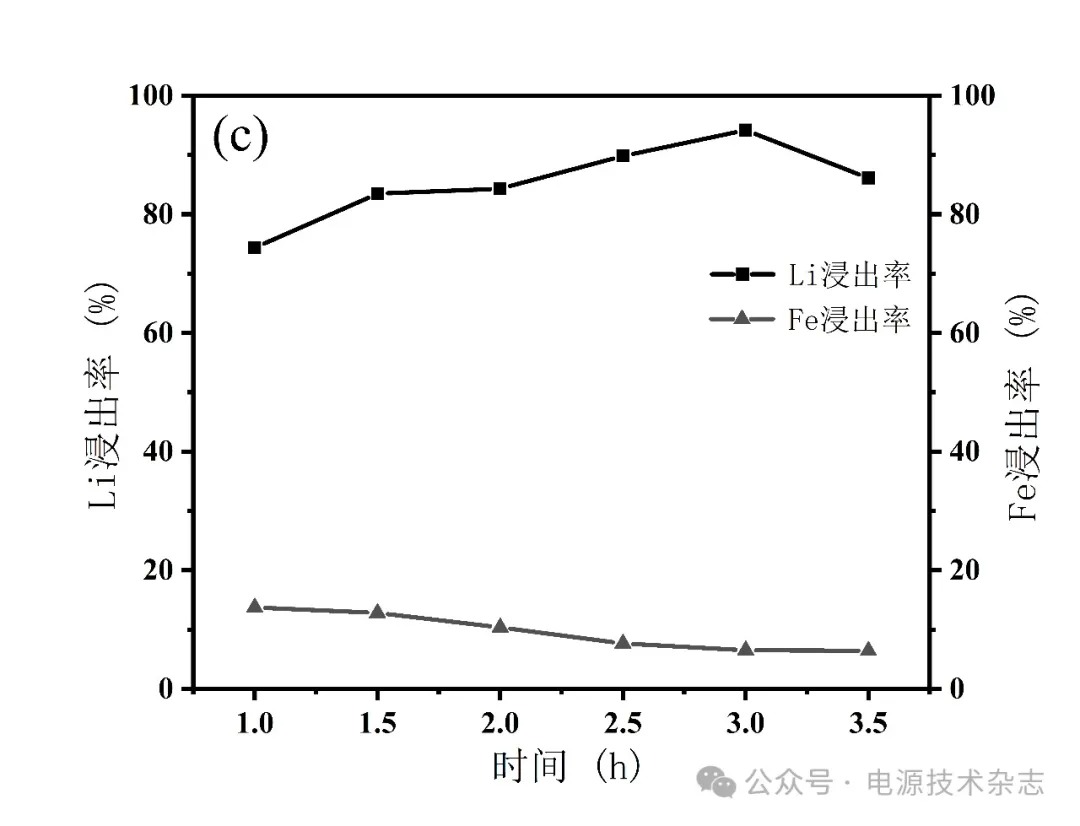
图6 反应时间对锂铁浸出率的影响
表6 反应时间对锂铁浸出率的影响
根据以上浸出实验的结果可知,在磷酸浓度3.41 mol/L,固液比1∶5,搅拌速度500 r/min,水浴温度70 ℃下反应3 h的条件下,锂的浸出率达到94.16%,铁的浸出率6.55%。其它研究显示,在轻度磷酸介质中进行LFP浸出,其最佳酸度条件下,锂的浸出率为93.53%,此时酸用量0.024 mol/L[16],而本文在最佳酸度条件下锂浸出率达到93.42%,酸用量仅为0.017 mol/L,优于在0.024 mol/L酸用量中进行的LFP浸出,降低了生产成本,提高了经济效益。
2.3 沉淀条件优化
本文通过氨水调节溶液pH使得磷酸铁和磷酸锂分步沉淀,进一步探究最佳磷酸锂沉淀操作条件。通过对pH值、反应时间和温度三个因素的调整,优化沉淀实验的条件,从而达到更高效回收磷酸锂的目的。研究表明[21],使用氨水调节浸出液pH值至2.0,80 ℃下水浴加热4 h沉淀回收率可达98.8%。而使用氨水调节浸出液pH至2.05,80 ℃下水浴加热4 h后进行真空抽滤处理,滤液中Fe3+与废旧磷酸铁锂材料中Fe的摩尔分数仅为0.53%,在此研究中,以铁在滤液中含量为标准,判断是否除去铁。
2.3.1 pH对锂沉淀率的影响
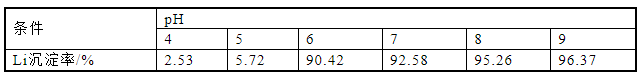
为研究不同pH值对Li沉淀率的影响,已知磷酸锂形成沉淀的pH值为5.5~8,在除铁溶液中滴加不同体积的氨水使溶液pH分别为4、5、6、7、8、9,反应时间为3 h,温度为70 ℃下进行实验,分别计算元素沉淀率,实验结果如图7、表7所示。pH值在5以下时,Li的沉淀率极低,最高仅为5.72%;pH增加至6时,Li沉淀率上升到90.42%。这是因为此时溶液pH已经达到磷酸锂开始沉淀时的pH,故产生大量的磷酸锂沉淀。在溶液pH上升到8时,Li沉淀率为95.26%,此时磷酸锂几乎完全沉淀。考虑到实验成本且需要保证高的磷酸锂沉淀率,最佳沉淀pH值为8。
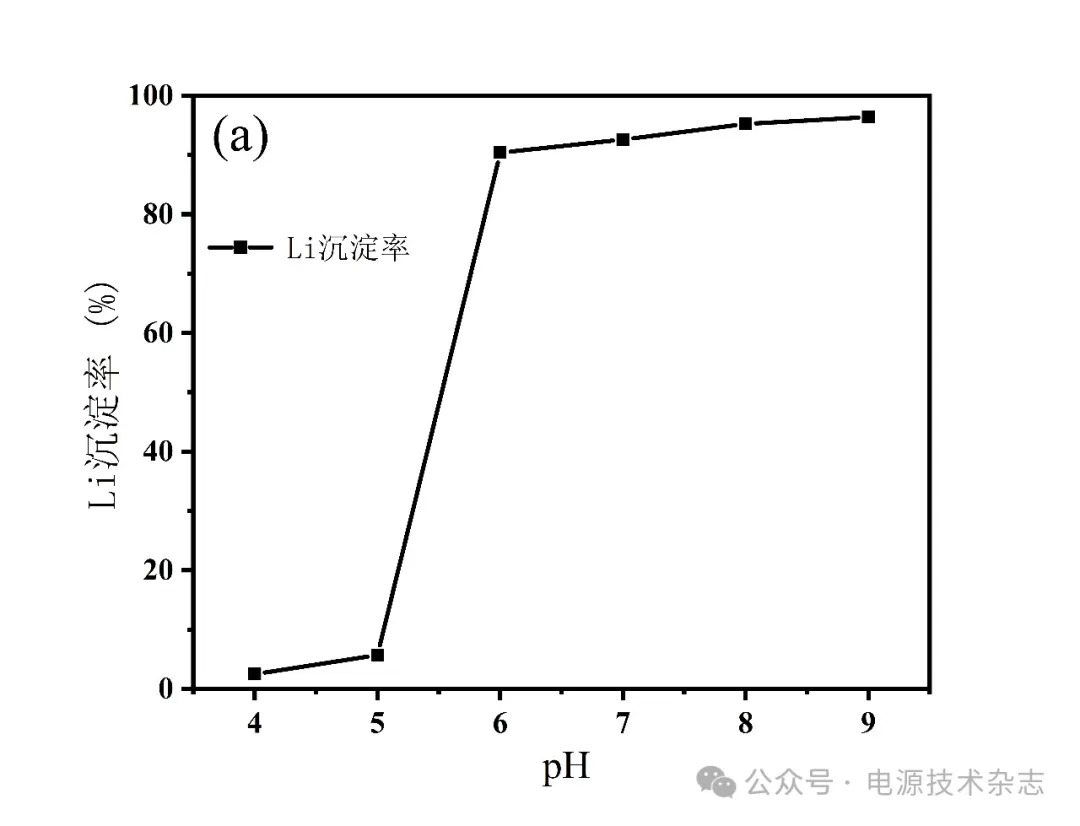
图7 pH值对锂沉淀率的影响
表7 pH值对锂沉淀率的影响
2.3.2 反应时间对锂沉淀率的影响
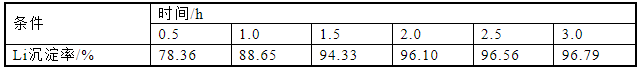
为研究不同反应时间对Li沉淀率的影响,反应时间控制在0.5~3 h,溶液在除铁后滴加氨水调节pH值到8,反应温度为70 ℃,计算元素沉淀率,实验结果如图8和表8所示。Li的沉淀率随反应时间从0.5 h延长至1.5 h时发生显著变化,之后随反应时间增加,Li的沉淀率变化趋于平稳。其中Li沉淀率最高为96.79%,反应时间为3 h。在2~3 h时,Li沉淀率随反应时间增加变化不明显,在96%~97%。从结果可知,反应时间对沉淀率有显著影响。沉淀率在延长反应时间内的波动归因于短时间内未充分反应。因此,反应时间控制在2 h以内,可以降低时间成本,同时保持良好的沉淀率。考虑到锂元素完全沉淀的因素和时间成本,反应时间设定为2 h。
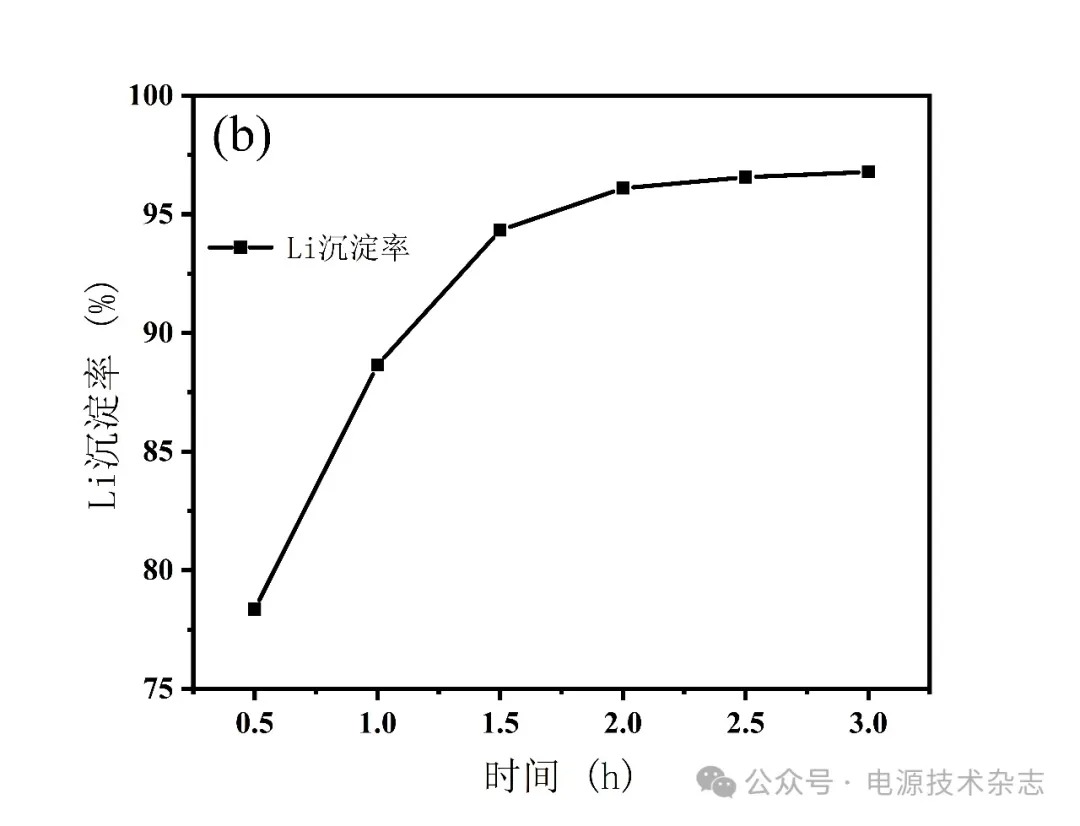
图8 反应时间对锂沉淀率的影响
表8 反应时间对锂沉淀率的影响
2.3.3 温度对锂沉淀率的影响
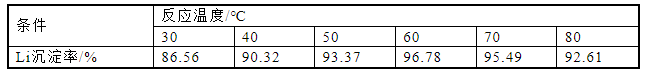
为了研究不同温度对Li沉淀率的影响,将温度控制在30~80 C,在除铁后溶液中滴加氨水调节pH值为8,反应时间2 h,计算元素沉淀率,实验结果如图9、表9所示。图9和表9显示,在反应温度从30 ℃上升至60 ℃的过程中,Li沉淀率从86.56%上升至96.78%,在温度从60 ℃升高至80 ℃的过程中,Li沉淀率降至92.61%。其原因在于氨水在温度升高的过程中会受热分解[22],从而使得pH值降低,导致Li沉淀率降低。考虑到温度升高引起的能耗增加且要保持高的Li沉淀率,选取60 ℃为最佳沉淀温度。
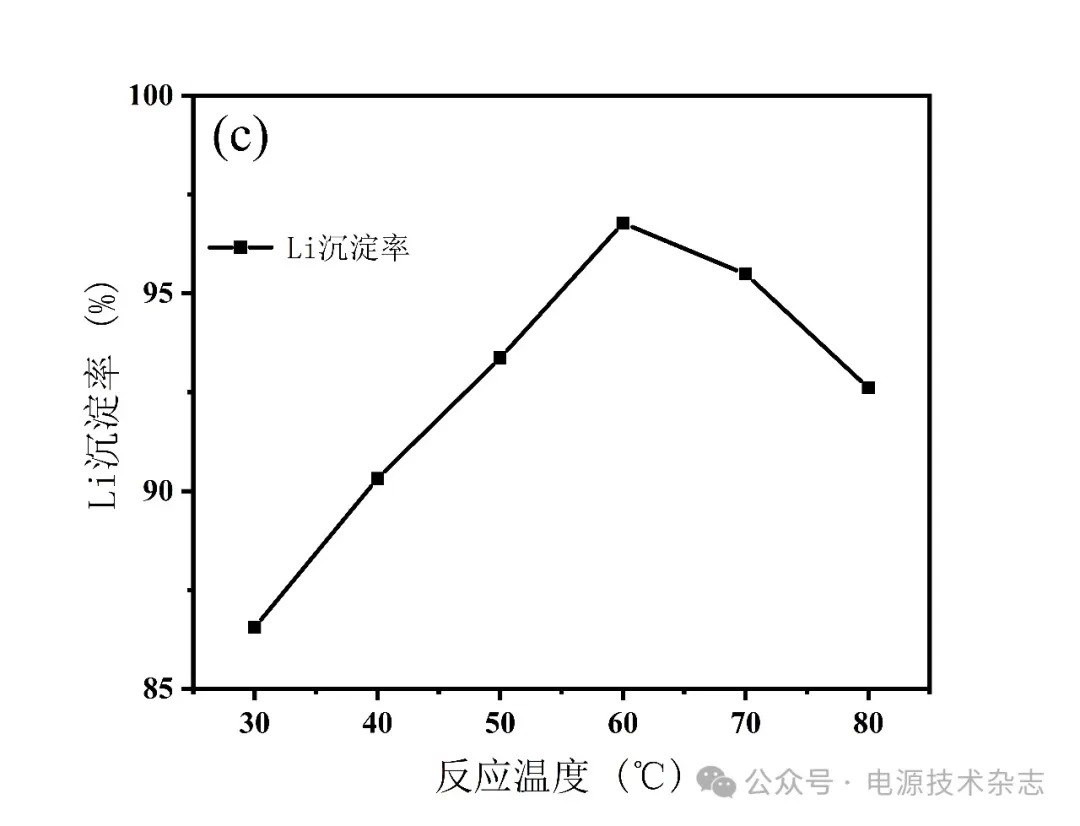
图9 反应温度对锂沉淀率的影响
表9 反应温度对锂沉淀率的影响
根据以上沉淀实验结果可知,最佳沉淀锂的条件为:溶液pH值为8,并且在60 ℃的水浴温度下反应2 h。该条件可使锂沉淀率达到96.78%。
3 结论
本文以烧结后磷酸铁锂正极粉末为原料,使用磷酸体系对废旧磷酸铁锂正极粉末中锂进行选择性浸出,探究了其在不同磷酸浓度、固液比、反应时间、温度以及转速等条件下锂和铁的元素浸出情况,以及不同浸出操作条件对于锂和铁浸出率的影响。以浸出后滤液为原料,用氨水调节pH值沉淀磷酸锂,探究了其在不同pH值、反应时间、温度下的沉淀行为。
通过浸出实验确定了浸出锂的最佳条件:废旧磷酸铁锂正极粉末在磷酸浓度3.41 mol/L,固液比1∶5,搅拌速度500 r/min,70 ℃的水浴温度下反应3 h的条件下,锂的浸出率达到94.16%,铁的浸出率6.55%。
通过沉淀实验确定了沉淀锂的最佳条件:保持溶液pH值为8,并且在60 ℃的水浴温度下反应2 h。该条件可使锂沉淀率达到96.78%。
本文研究成果可为废旧磷酸铁锂电池中锂的选择性回收降低成本。通过单因素实验降低了药剂成本,选择性回收也在一定程度上缩短了其工艺流程,减少了设备投入,提高了经济效益。
资讯来源:电源技术杂志
免责声明: 本站内容转载自合作媒体、机构或其他网站的信息,转载此文仅出于传递更多信息的目的,但这并不意味着赞同其观点或证实其内容的真实性。本站所有信息仅供参考,不做交易和服务的根据。本站内容如有侵权或其它问题请及时告之,本网将及时修改或删除。凡以任何方式登录本网站或直接、间接使用本网站资料者,视为自愿接受本网站声明的约束。